-
Piomelli,
Daniele (2000). "Arachidonic
Acid".
Neuropsychopharmacology: The Fifth Generation of Progress. New
York: Chapman & Hall. ISBN 0-412-10951-4.
Archived from the
original
on 2006-07-15. Retrieved 2006-03-03.
torsdag 7 juni 2018
onsdag 6 juni 2018
Beheenihappo C22:0- mitä siitä voi päätellä
https://www.ncbi.nlm.nih.gov/pubmed/24257229
Can J Neurol Sci. 2013 Nov;40(6):854-6.
Can Behenic Acid (C22:0) Levels be a Prognostic Factor in Glial Tumors?
Abstract BACKGROUND:
Rasvahapposyntaasin esto johtaa syövän apoptoosiin niissä syövissä, jotka aiheutavat rasvahapposynteesin korkeita tasoja. Tämä viittaa siihen, että syöpäsolut riippuvat rasvahaposta jotta pysyvät hengissä. Tässä tutkimuksessa selvitetään, onko gliiatuumorin asteen ja tuumorikudoksen vapaiden rasvahappojen pitoisuuden välillä korrelaatiota. Tutkimusmateriaalina oli operaatioiden aikana saatuja gliiatuumorinäytteitä ja niistä määritettiin vapaitten rasavhappojen pitoisuudet. SFA, MUFA ja PUFA ryhmät. Ne analysoitiin kaasukromatografialla. Tulokset: matala-asteisissa tuumoreissa tuumorikudoksessa oli korkeat pitoisuudet öljyhappoa(C18:1), linolihappoa( C18:2n6), eikosadieenihappoa (C20:2) ja dokosadieenihappoa (C22:2). Korkean asteen glioomatuumoreissa oli korkeita pitoisuuksia myristiinihappoa (C:14), palmitiinihappoa (C16:0), steariinihappoa (C18:0) , alfa-linoleenihappoa (C18:3,n3), eikoseenihappoa (C20:2), dihomogammalinoleenihappoa (C20:3,n6), dokosahexaeenihappoa (DHA) ja keramideja (Cer) .JOHTOPÄÄTÖS_ Beheenihapon korkeat pitoisuudet matala-asteista gliomaa potevilla on tärkeä seikkä, koska se viittaa kudosintegriteetin jäljelläolemiseen ja kudoksen vastustuskykyyn. Behenihappopitoisuuksia voi pitää prognostisena tekijänä gliiatuumoreissa.- Inhibition of fatty acid synthase leads to apoptosis in cancers, which leads to high levels of fatty acid synthesis. This indicates that cancer cells depend on fatty acid in order to survive. In this study, we investigated whether or not there was a relationship between the glial tumor grade and free fatty acid level of tumor tissue. METHODS: Twenty patients who had high grade glial tumors and 20 patients who had low grade glial tumors, were included in the study. Tumors samples were obtained intraoperatively in order to measure the fatty acid levels. The fatty acids were studied in three groups: saturated fatty acids, monounsaturated fatty acids and polyunsaturated fatty acids. They were analyzed with gas chromatography. RESULTS: The oleic acid, linoleic acid, eicosadienoic acid, arachidonic acid, and docosadienoic acid levels were high in the tumor tissue of low grade tumors. The myristic acid, palmitic acid, stearic acid, alpha linoleic acid, eicosenoic acid, dihomo-gamma-linolenic acid, docosahexaenoic acid, and ceramide levels were high in the tumor tissue of high grade glial tumors. However, none of these high values were statistically significant. The high values of behenic acid, a saturated fatty acid, in low grade glial tumors were statistically significant. CONCLUSION: High levels of behenic acid in patients with low grade glial tumor is important as it indicates persistence of the tissue integrity and tissue resistance. behenic acid levels can be a prognostic factor in glial tumors.
Lignoseerihappo löytyy tyydyttyneiden rasvahappojen systemaattisesta listasta
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/lignoceric-acid
LISTA
https://fi.wikipedia.org/wiki/Luettelo_tyydyttyneist%C3%A4_rasvahapoista
Tämä on terminologian kannalta hyvä lista , muta luonnossa keho ei tee tällaista noin pitkää järjestelmää ja ensisijassa käyttää parillisten rasvahappojen legomasita kokoamista hyödyksi.
Mutta joitain parittomia rasvahappoja tulee varsinkin aineenvaihdunnassa siten, että betaoksidaatiossa pätkiessä rasvahappoja takaisin kahden hiilen pätkinä jää lopulta pariton kolmenhidien pätkä, propionihappo C3:0 ja jos sattuu olemaan tarvetta tai synteesi on päällä, siihen alkaa lisääntyä 2 hiilen pätkiä ja niin saadaan uusia parittomia kokoja kehoonkin. Niiden parittomien loppupätkien oksidaatio vaatii mm. B12 vitamiinin avulla tapahtuvaa struktuurin muokkausta.
Lignoseerihappo, jonka takia otin listasta sitaatin, on C24:0 tyydyttynyt rasvahappo. Aivoissa se taitaa olla pisin normaali tätä linjaa, sillä sitä seuraava parillinen on jo mehiläisvahaa: keroottihappo. Eräässä taudissa havaitaan kyllä lignoseriinihapon edelleen ottaneen C-pätkän lisää keroottihapoksi asti, mutta silloin on jo kyse katabolisesta vajeesta jostain syystä niin että lignoseriiniä jää kertymään. (peroksisomaalinen tauti) ja edelleen kasvamaan.
VLCFA = Very Long Chain Fatty Acids
https://en.wikipedia.org/wiki/Very_long_chain_fatty_acid
Wikipedian suomalainen kemian luettelo rasvahapoista
Huom. etikkahappo C2:0 ei katsota rasvahapoksi! Siitä tehdään kehossa rasvahapot lisäämällä niitä tarpeaksi peräkkäin. Propionihappo kehossa on jätetuote joka jää jäljelle pitkistä parittomista rasvahapoista tai joistain aminohapoista ja voidaan uudestaan alkaa kasvattaa 5, 7, 9 jne kokoon lisäämällä 2- hiilen etikkahappoja.
Luettelo tyydyttyneistä rasvahapoista
joitain lyhyehköjä parittomia rasvahappoja tulee ihmisenkin ainenenvaihdunnassa siten, että betaoksidaation pätkiessä rasvahappoja takaisin kahden hiilen pätkinä jää lopulta pariton kolmenhiilen pätkä, propionihappo ja jos sattuu olemaan tarvetta tai synteesihenki on päällä, siihen alkaa lisäytyä 2 hiilen pätkiä ja niin saadaan uusia parittomia kokoja kehoonkin pieni määrä. Niiden loppupätkän oksidaatio vaatii mm. B12 vitamiinin avulla tapahtuvaa struktuurin muokkausta soveltuvaksi, jota se voitaisiin syöttää sitruunahappokiertoon portista, jonka nimi on
meripihkahappo.
Kehon fundamentaalijärjstelmä on hyvin tiukka eikä tallainen kemiallinen lista. Joka vaiheella on oma entsyyminsä. niin rakentamisessa kuin purkamisessa. Paras normalisoija konesitoon on liikunta, raikas veden ja kohtalainen energian ja ravintoaineiden käyttö. Paljon muuta ei voi tehdä asian hyväki. varinainen dieetin kvalitatiivine modifiointi omaa vain raajllisen merkityksen ( jos merkitsevästi mitään- vaikka tiede koettaa löytää asian merkitsevyytä yhä uudestaan. Ilman raikkaan veden käyttöä ja liikuntaa rasvakvalitetti ravinnossa ei pääse oikeuksiinsa.
Nervonihappo (C24:1)
Nervonihappo C24:1 ,n9
https://fi.wikipedia.org/wiki/Nervonihappo
Nervonihappo eli cis-15-tetrakoseenihappo eli 24:1 (ω−9) on monityydyttymätön omega-9-rasvahappo, jonka kemiallinen kaava on C24H46O2, moolimassa 366,62 g/mol ja sulamispiste 42-43 celsiusastetta. Yhdisteen CAS-numero on 506-37-6. Nervonihappoa on löydetty hermosolujen myeliineistä ja se on tärkeä osa aivosolujen biosynteesiä. Nervonihappoa käytetään myös MS- ja ALD-taudin hoidossa.
https://www.ncbi.nlm.nih.gov/pubmed/175848
Nervonic acid is a long chain unsaturated fatty acid that is enriched in sphingomyelin.
It consists of choline, sphingosine, phosphoric acid, and fatty acid.
Nervonic acid may enhance the brain functions and prevent demyelination (Chemical Land21). Research shows that there is negative relationship between nervonic acid and obesity-related risk factors (PMID: 16394593).
Demyelination in adrenoleukodystrophy (ALD) is associated with an accumulation of very long chain saturated fatty acids stemming from a genetic defect in the peroxisomal beta oxidation system responsible for the chain shortening of these fatty acids.
Sphingolipids from post mortem ALD brain have decreased levels of nervonic acid, 24:1(n-9), and increased levels of stearic acid, 18:0. (PMID: 8072429).
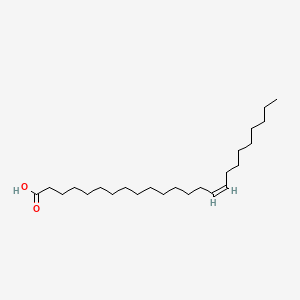
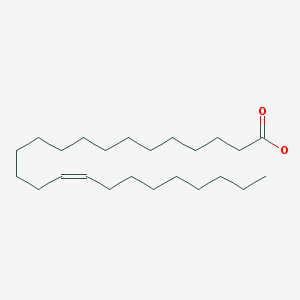 Tämä muoto kaavassa on sikäli edullinen että siihen voi verratt PUFA rsvahappojen kavoja ja sitten voi katsoa, vaikuttavatko PUFA-alueen entsyymit jotain tähän happoon. ja mitä. Tietysti tämä hahmo vaatii kyllä jonkin ympäristövaikutuksen( ympärilläolevien rasvahappojen vaikutuksen ) taipuakseen tuolla tavalla kulmassa - pohdin vain.
Tämä muoto kaavassa on sikäli edullinen että siihen voi verratt PUFA rsvahappojen kavoja ja sitten voi katsoa, vaikuttavatko PUFA-alueen entsyymit jotain tähän happoon. ja mitä. Tietysti tämä hahmo vaatii kyllä jonkin ympäristövaikutuksen( ympärilläolevien rasvahappojen vaikutuksen ) taipuakseen tuolla tavalla kulmassa - pohdin vain.
https://fi.wikipedia.org/wiki/Nervonihappo
Nervonihappo eli cis-15-tetrakoseenihappo eli 24:1 (ω−9) on monityydyttymätön omega-9-rasvahappo, jonka kemiallinen kaava on C24H46O2, moolimassa 366,62 g/mol ja sulamispiste 42-43 celsiusastetta. Yhdisteen CAS-numero on 506-37-6. Nervonihappoa on löydetty hermosolujen myeliineistä ja se on tärkeä osa aivosolujen biosynteesiä. Nervonihappoa käytetään myös MS- ja ALD-taudin hoidossa.
Aiheesta muualla
- PubChem: Nervonic acid (englanniksi)
- Human Metabolome Database: Nervonic acid (englanniksi)
- Kyoto Encyclopedia of Genes and Genomes (KEGG): Nervonic acid (englanniksi)
- ChemBlink: Nervonic acid (englanniksi)
- OLENNAISTA ja tärkeää tietoa nervonihapon synteesistä: Kannattaa katsoa tämä tieto.
https://www.ncbi.nlm.nih.gov/pubmed/175848
- Artikkeli Pubmed:
Nervonic acid is a long chain unsaturated fatty acid that is enriched in sphingomyelin.
It consists of choline, sphingosine, phosphoric acid, and fatty acid.
Nervonic acid may enhance the brain functions and prevent demyelination (Chemical Land21). Research shows that there is negative relationship between nervonic acid and obesity-related risk factors (PMID: 16394593).
Demyelination in adrenoleukodystrophy (ALD) is associated with an accumulation of very long chain saturated fatty acids stemming from a genetic defect in the peroxisomal beta oxidation system responsible for the chain shortening of these fatty acids.
Sphingolipids from post mortem ALD brain have decreased levels of nervonic acid, 24:1(n-9), and increased levels of stearic acid, 18:0. (PMID: 8072429).

- 15-Tetracosenoic acid
- 91OQS788BE
- CHEBI:44247
- (15Z)-tetracos-15-enoic acid
- cis-Delta(15)-tetracosenoic acid
- GWHCXVQVJPWHRF-KTKRTIGZSA-N
- MFCD00010507
- AK307332
- cis-15-tetracosenoate
- (Z)-15-tetracosenoate
 Tämä muoto kaavassa on sikäli edullinen että siihen voi verratt PUFA rsvahappojen kavoja ja sitten voi katsoa, vaikuttavatko PUFA-alueen entsyymit jotain tähän happoon. ja mitä. Tietysti tämä hahmo vaatii kyllä jonkin ympäristövaikutuksen( ympärilläolevien rasvahappojen vaikutuksen ) taipuakseen tuolla tavalla kulmassa - pohdin vain.
Tämä muoto kaavassa on sikäli edullinen että siihen voi verratt PUFA rsvahappojen kavoja ja sitten voi katsoa, vaikuttavatko PUFA-alueen entsyymit jotain tähän happoon. ja mitä. Tietysti tämä hahmo vaatii kyllä jonkin ympäristövaikutuksen( ympärilläolevien rasvahappojen vaikutuksen ) taipuakseen tuolla tavalla kulmassa - pohdin vain. Kerebronihappo , 2-hydroxytetrakosaanihappo
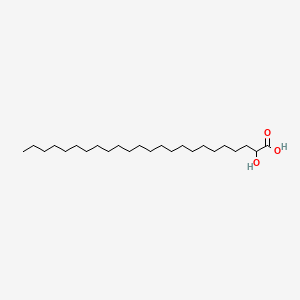
https://pubchem.ncbi.nlm.nih.gov/compound/2-Hydroxytetracosanoic_acid#section=Top
C24H48O
Tämä rasvahappo vaatii oksidaatiossaan alfa-oksidaation, mistä voi tulla jollekin yksilöille ongelmaa alfa-oksidaation heikkouden takia. se vaatii peroksisomaalisen oksidaation.
https://www.ncbi.nlm.nih.gov/pubmed/11104019
Tällä rasvahappomuodolla näyttää oelvan useampiakin merkityksiä tautipuolella.
Tällä hapolla on paljon synonyymisiä nimiä:
- 2-Hydroxytetracosanoic acid
- Cerebronic acid
- 544-57-0
- Phrenosic acid
- Phrenosinic acid
- DL-Cerebronic acid
- 2-hydroxy-tetracosanoic acid
- Cerebronsaeure
- acide cerebronique
- a-hydroxylignoceric acid
- 2-hydroxylignoceric acid
- AC1L2SRS
- 2-Hydroxy-tetracosansaeure
- 2-hydroxytetraicosanoic acid
- AC1Q5ST6
- 2-hydroxytetraeicosanoic acid
- SCHEMBL338278
- CHEBI:61302
- CTK6D9796
- LMFA01050080Haen hakusanalla phrenosic acid lisätietoja.http://www.hmdb.ca/metabolites/HMDB0039540
DL-Cerebronic acid, also known as acide cerebronique or cerebronsaeure, belongs to the class of organic compounds known as very long-chain fatty acids. These are fatty acids with an aliphatic tail that contains at least 22 carbon atoms.
DL-Cerebronic acid is considered to be a practically insoluble (in water) and relatively neutral molecule. DL-Cerebronic acid has been primarily detected in urine. Within the cell, DL-cerebronic acid is primarily located in the membrane (predicted from logP), cytoplasm and adiposome. DL-Cerebronic acid participates in a number of enzymatic reactions. In particular, DL-cerebronic acid can be biosynthesized from tetracosanoic acid. DL-Cerebronic acid is also a parent compound for other transformation products, including but not limited to, N-2-hydroxylignoceroylsphingosine, 2-hydroxytetracosanoyl-CoA, and N-(2-hydroxylignoceroyl)-D-galactosylsphingosine. Outside of the human body, DL-cerebronic acid can be found in mushrooms. This makes DL-cerebronic acid a potential biomarker for the consumption of this food product.
Miksi pitkät omega3 rasvahapot ovat aivoedullisia?
Tiedetäänhän, että esim dieetin DHA ei sinänsä itse sinä muodossaan "mene aivoon", vaan käyttyy energiaksi. Sen oma pitoisuus ei siitä aivossa nouse.
Hyöty mikä kalaruoasta ja omega3-rasavhappojen käytöstä on epäsuoraa. ensinnäkin se demppaa, suppressoi villiä eikosanoidilinjaa, joka tulee omega6 rasvahapoista- miten paljon siitä tuleekaan signaloivia ja biokatiiveja osin tuntemattomiakin molekyylejä! - ja toiseksi ilmeisesti edistää palmitiinihaposta ja öljyhaposta silmukoituvaa erittäin pitkää aivorasvahappo linjaa siten että niitä mudoostuu eikä karkaa muille teille, joita on runsaasti.
ne normaalit pitkät aivojen neutraalit ja MUFA-rasvahapot ovat lignoseriinihappo C24:0, nervonihappo ja cerebronihappo. Aivojen pitkissä hapoissa niitä asettuu vierelle.
kuten perifeerisissä kudoksissa asettuu tyydyttyneitä rasvahappoja tyydyttämättömien vierelle triglyserideissä. ja fosfolipideissä kudosspesifisessa genomisesti säätyneessä prioriteetissa.
Tästä alkaa olla vähän näyttöä tekstinäkin.
https://www.ncbi.nlm.nih.gov/pubmed/29252041
Huom: Historiallinen tieto: Harper 1969:
"The cerebrosides are glykolipids which contain the sphingosine-fatty acid combination (ceramide) found in the sphinomyelins, but a galactose moieti is attached to the ceramide in the place of the phosphoryl choline residue found in sphingomyelin. The biosynthesis of characteristic C24 fatty acids which occur in cerebrosides (lignoceric acid (C24:0), cerebronic acid (hC24:0) and nervonic acid ( C24.1) has been studied by Fulco et Mead 1961. Lignoceric acid (C24:09 is completely synthesized from acetate (C2:0). Cerebronic acid , the 2-hydroxy derivative of lignoceric acid, is formed from it. Nervonic acid (C24:0 n9), is formed by elongation of oleic acid (C18:1 n9).
The requirement for galactose in the formation oc cerebrosides is the only known physiological role of this sugar other than in the formation of lactose in milk (1969).
Hyöty mikä kalaruoasta ja omega3-rasavhappojen käytöstä on epäsuoraa. ensinnäkin se demppaa, suppressoi villiä eikosanoidilinjaa, joka tulee omega6 rasvahapoista- miten paljon siitä tuleekaan signaloivia ja biokatiiveja osin tuntemattomiakin molekyylejä! - ja toiseksi ilmeisesti edistää palmitiinihaposta ja öljyhaposta silmukoituvaa erittäin pitkää aivorasvahappo linjaa siten että niitä mudoostuu eikä karkaa muille teille, joita on runsaasti.
ne normaalit pitkät aivojen neutraalit ja MUFA-rasvahapot ovat lignoseriinihappo C24:0, nervonihappo ja cerebronihappo. Aivojen pitkissä hapoissa niitä asettuu vierelle.
kuten perifeerisissä kudoksissa asettuu tyydyttyneitä rasvahappoja tyydyttämättömien vierelle triglyserideissä. ja fosfolipideissä kudosspesifisessa genomisesti säätyneessä prioriteetissa.
Tästä alkaa olla vähän näyttöä tekstinäkin.
https://www.ncbi.nlm.nih.gov/pubmed/29252041
The effect of fish oil supplementation on brain DHA and EPA content and fatty acid profile in mice.
Tiivistelmä _Abstract
omega-3 rasvahapporavintolisä saataa koehntaa kognitiivista suorituskykyä ja suojata kognition alamäeltä. Kuitenkin omega3-rasvahapposupplementaation jälkeisiä aivofosfolipidien rasvahappokirjoja vain on niukalti kuvattu. Tässä on tehty asian selvittämiseksi hiirikoe. Syötettiin aksvavia määriä omega3- rasvoja ja kuvattiin, mitä muutoksia aivojen fosfolipidien kokoomuksessa tapahtui ja korreloitiin muutoksia punasoluista ja plasmasta havaittuihin muutoksiin.
Kohoavat DHA (C22:6 omega3) ja EPA (C20:5 omega3- rasvahappopitoisuudet eivät nosta aivojen DHA-pitoisuutta.
Aivojen EPA 8C20:5 omega3) -pitoisuus kuitenkin lisääntyi ja totaali omega-6 PUFA-rasvahappojen pitoisuus aleni kaikissa käsittelyryhmissä ja nämä muutokset korreloivat punasolujen rasvahappojen muutoksiin. (omega6 rasvahappoja on arakidonihappo C20:4 n6)
Aivojen cis-MUFA rasvahapot öljyhappo (C18:1 n9) ja nervonihappo (C24:1) lisääntyivät, samoin aivojen tyydyttyneet rasvahapot arakidiinihappo (C20:0 n7), beheenihappo ja lignoseriinihappo (C24:0). Nämä aivorasvahapot lisääntyivät, kun omega3- rasvahappojen saantia lisättiin. Asiaa tulisi edelleen tutkia, jotta vaikutus kognitioon ja neurodegeneratiivisiin tauteihin saadaan selvitettyä.
Supplementation with omega-3 (n-3) fatty acids may improve cognitive performance and protect against cognitive decline. However, changes in brain phospholipid fatty acid composition after supplementation with n-3 fatty acids are poorly described. The purpose of this study was to feed increasing n-3 fatty acids and characterise the changes in brain phospholipid fatty acid composition and correlate the changes with red blood cells (RBCs) and plasma in mice. Increasing dietary docosahexaenoic (DHA) and eicosapentaenoic acid (EPA) did not alter brain DHA. Brain EPA increased and total n-6 polyunsaturated fatty acids decreased across treatment groups, and correlated with fatty acid changes in the RBC (r > 0.7). Brain cis-monounsaturated fatty acids oleic and nervonic acid (p < .01) and saturated fatty acids arachidic, behenic, and lignoceric acid (p < .05) also increased. These brain fatty acid changes upon increasing n-3 intake should be further investigated to determine their effects on cognition and neurodegenerative disease.
Kohoavat DHA (C22:6 omega3) ja EPA (C20:5 omega3- rasvahappopitoisuudet eivät nosta aivojen DHA-pitoisuutta.
Aivojen EPA 8C20:5 omega3) -pitoisuus kuitenkin lisääntyi ja totaali omega-6 PUFA-rasvahappojen pitoisuus aleni kaikissa käsittelyryhmissä ja nämä muutokset korreloivat punasolujen rasvahappojen muutoksiin. (omega6 rasvahappoja on arakidonihappo C20:4 n6)
Aivojen cis-MUFA rasvahapot öljyhappo (C18:1 n9) ja nervonihappo (C24:1) lisääntyivät, samoin aivojen tyydyttyneet rasvahapot arakidiinihappo (C20:0 n7), beheenihappo ja lignoseriinihappo (C24:0). Nämä aivorasvahapot lisääntyivät, kun omega3- rasvahappojen saantia lisättiin. Asiaa tulisi edelleen tutkia, jotta vaikutus kognitioon ja neurodegeneratiivisiin tauteihin saadaan selvitettyä.
Supplementation with omega-3 (n-3) fatty acids may improve cognitive performance and protect against cognitive decline. However, changes in brain phospholipid fatty acid composition after supplementation with n-3 fatty acids are poorly described. The purpose of this study was to feed increasing n-3 fatty acids and characterise the changes in brain phospholipid fatty acid composition and correlate the changes with red blood cells (RBCs) and plasma in mice. Increasing dietary docosahexaenoic (DHA) and eicosapentaenoic acid (EPA) did not alter brain DHA. Brain EPA increased and total n-6 polyunsaturated fatty acids decreased across treatment groups, and correlated with fatty acid changes in the RBC (r > 0.7). Brain cis-monounsaturated fatty acids oleic and nervonic acid (p < .01) and saturated fatty acids arachidic, behenic, and lignoceric acid (p < .05) also increased. These brain fatty acid changes upon increasing n-3 intake should be further investigated to determine their effects on cognition and neurodegenerative disease.
KEYWORDS:
Brain; DHA; EPA; desaturase; fatty acid; phospholipid- PMID:
- 29252041
- DOI:
- 10.1080/09637486.2017.1413640
"The cerebrosides are glykolipids which contain the sphingosine-fatty acid combination (ceramide) found in the sphinomyelins, but a galactose moieti is attached to the ceramide in the place of the phosphoryl choline residue found in sphingomyelin. The biosynthesis of characteristic C24 fatty acids which occur in cerebrosides (lignoceric acid (C24:0), cerebronic acid (hC24:0) and nervonic acid ( C24.1) has been studied by Fulco et Mead 1961. Lignoceric acid (C24:09 is completely synthesized from acetate (C2:0). Cerebronic acid , the 2-hydroxy derivative of lignoceric acid, is formed from it. Nervonic acid (C24:0 n9), is formed by elongation of oleic acid (C18:1 n9).
The requirement for galactose in the formation oc cerebrosides is the only known physiological role of this sugar other than in the formation of lactose in milk (1969).
Etiketter:
Omega3 rasvojen tärkeä tasapanottava tehtävä
tisdag 5 juni 2018
Tässä artikkelissa kuvataan monityydyttämättömien rasvahappojen AA, EPA ja DHA biotransformaatio niiden vastaaviksi hepoxiliineiksi ja trioksiliineiksi.
https://www.nature.com/articles/s41467-017-02543-8#auth-1
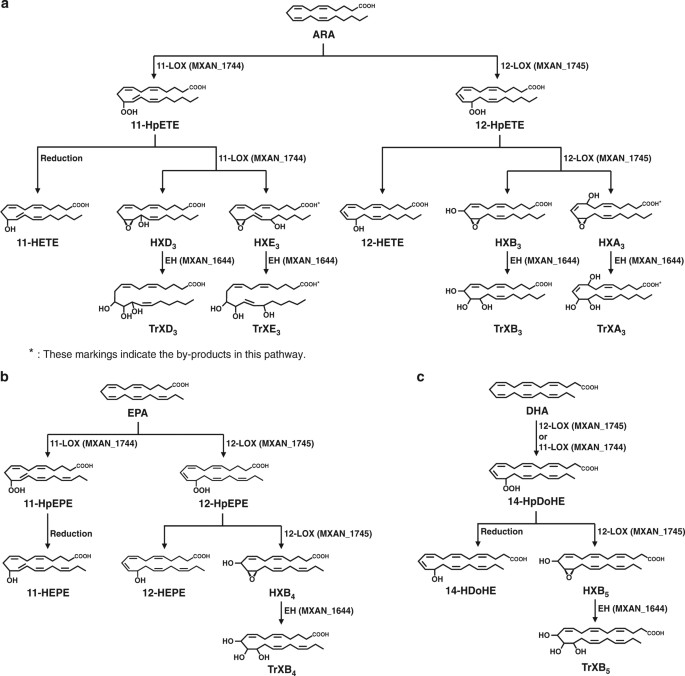
https://www.nature.com/articles/s41467-017-02543-8#auth-1

Etiketter:
EPA ja DHA rasvahapoista,
Hepoxiliinit,
trioksiliinit AA
1997 mainitaan hepoxiliinit ja trioksiliinit rasvahappojohdannaisissa eikosanoideissa
tämä artikkeli on niin hyvä katsaus , että otan sitaatin blogiini. https://www.ncbi.nlm.nih.gov/pubmed/9475035
Indian J Exp Biol. 1997 Oct;35(10):1025-31.
An update on eicosanoids and inhibitors of cyclooxygenase enzyme systems.
Abstract
There
are 3 main enzymatic pathways for synthesis of eicosanoids from
arachidonic acid, however, some compounds are also formed
non-enzymatically.
Among the enzymatic pathways, cyclooxygenase (COX) also known as prostaglandin synthase (PGHS), generates endoperoxides (PGG/H). These are converted into prostaglandins (PGs) and thromboxanes (TXs).
The second pathway involves lipooxygenase (LOX) group of enzymes to provide hydroperoxyeicosatetraenoic acid (HpETEs) which in turn can be converted into leukotrienes (LTs), hepoxilins (HXs), trioxilins and lipoxins (LXs).
The third pathway involves cytochrome P-450 which catalyses the formation of a number of monohydroxy fatty acids (hydroxyeicostetraenoic acids or HETEs) dihydroxy fatty acids (dihydroxyeicostetrienoic acids or DiHETrEs) and epoxyeicosatrienoic acids (EpETrEs: formerly called EETs). This system also provides leukotoxins.
The non-enzymatic pathway leads to the formation of isoprostanes by free radical catalysed peroxidation of arachidonic acid.
In addition, brain cells also convert arachidonic acid into arachidonylethanolamide (anandamide) which have the ability to bind to cannabinoid receptors.
Most of these eicosanoids are either biologically active or are converted into metabolites which have biological activities.
Cyclooxygenase is now known to exist in two separate isoforms which are called COX-1 and COX-2. While both isoforms catalyse the same reactions, the former is a constitutive enzyme and its activity is not markedly changed once the cell is fully grown. The later isoform is however inducible and its activity is several fold increased following the exposure of body cells to a number of stimuli and its contribution in the process of inflammation is now well documented. It is now believed that eicosanoids produced by COX-1 activity are essential for the physiological (house keeping) functions while those produced by COX-2 lead to various pathological changes in body tissues.
Older nonsteroidal antiinflammatory drugs like aspirin and indomethacin are non selective inhibitors of COX activity and therefore, in addition to inhibiting COX-2 activity, inhibit the formation of eicosanoids by COX-1. The later are required for normal house keeping functions such as secretion of mucus for protection of gastrointestinal mucosa, maintenance of renal function and control of haemostasis. Use of older non-selective NSAIDs has been associated with a number of gastrointestinal, renal and other side effects. Recently drugs such as nimesulide and meloxicam with selective action on COX-2 have been discovered and introduced into medicine. Evidence available so far has indicated the low incidence of side effects with these drugs. While being useful for various arthritic and other conditions, it is unlikely that these drugs will replace aspirin for the cardiovascular disease.
Among the enzymatic pathways, cyclooxygenase (COX) also known as prostaglandin synthase (PGHS), generates endoperoxides (PGG/H). These are converted into prostaglandins (PGs) and thromboxanes (TXs).
The second pathway involves lipooxygenase (LOX) group of enzymes to provide hydroperoxyeicosatetraenoic acid (HpETEs) which in turn can be converted into leukotrienes (LTs), hepoxilins (HXs), trioxilins and lipoxins (LXs).
The third pathway involves cytochrome P-450 which catalyses the formation of a number of monohydroxy fatty acids (hydroxyeicostetraenoic acids or HETEs) dihydroxy fatty acids (dihydroxyeicostetrienoic acids or DiHETrEs) and epoxyeicosatrienoic acids (EpETrEs: formerly called EETs). This system also provides leukotoxins.
The non-enzymatic pathway leads to the formation of isoprostanes by free radical catalysed peroxidation of arachidonic acid.
In addition, brain cells also convert arachidonic acid into arachidonylethanolamide (anandamide) which have the ability to bind to cannabinoid receptors.
Most of these eicosanoids are either biologically active or are converted into metabolites which have biological activities.
Cyclooxygenase is now known to exist in two separate isoforms which are called COX-1 and COX-2. While both isoforms catalyse the same reactions, the former is a constitutive enzyme and its activity is not markedly changed once the cell is fully grown. The later isoform is however inducible and its activity is several fold increased following the exposure of body cells to a number of stimuli and its contribution in the process of inflammation is now well documented. It is now believed that eicosanoids produced by COX-1 activity are essential for the physiological (house keeping) functions while those produced by COX-2 lead to various pathological changes in body tissues.
Older nonsteroidal antiinflammatory drugs like aspirin and indomethacin are non selective inhibitors of COX activity and therefore, in addition to inhibiting COX-2 activity, inhibit the formation of eicosanoids by COX-1. The later are required for normal house keeping functions such as secretion of mucus for protection of gastrointestinal mucosa, maintenance of renal function and control of haemostasis. Use of older non-selective NSAIDs has been associated with a number of gastrointestinal, renal and other side effects. Recently drugs such as nimesulide and meloxicam with selective action on COX-2 have been discovered and introduced into medicine. Evidence available so far has indicated the low incidence of side effects with these drugs. While being useful for various arthritic and other conditions, it is unlikely that these drugs will replace aspirin for the cardiovascular disease.
- PMID:
- 9475035
Hepoxiliineja ja trioxiliineja alettu selvittää edelleen 2018
https://www.ncbi.nlm.nih.gov/pubmed/29317615
2.
https://www.ncbi.nlm.nih.gov/pubmed/26666460
3.
https://www.ncbi.nlm.nih.gov/pubmed/26677076
4.
https://www.ncbi.nlm.nih.gov/pubmed/20016244
5. Angioneogenesis?? Tästä löytyi : psoriasis.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5895645/figure/F2/
6. hepoxilin, psoriasis
https://www.ncbi.nlm.nih.gov/pubmed/?term=hepoxilin%2C+psoriasis
Nat Commun. 2018 Jan 9;9(1):128. doi: 10.1038/s41467-017-02543-8.
Biotransformation of polyunsaturated fatty acids to bioactive hepoxilins and trioxilins by microbial enzymes.
Abstract
Hepoxilins (HXs) and trioxilins
(TrXs) are involved in physiological processes such as inflammation,
insulin secretion and pain perception in human. They are metabolites of
polyunsaturated fatty acids (PUFAs), including arachidonic acid,
eicosapentaenoic acid and docosahexaenoic acid, formed by
12-lipoxygenase (LOX) and epoxide hydrolase (EH) expressed by mammalian
cells.
Here, we identify ten types of HXs and TrXs, produced by the prokaryote Myxococcus xanthus, of which six types are new, namely, HXB5, HXD3, HXE3, TrXB5, TrXD3 and TrXE3.
We succeed in the biotransformation of PUFAs into eight types of HXs (>35% conversion) and TrXs (>10% conversion) by expressing M. xanthus 12-LOX or 11-LOX with or without EH in Escherichia coli. We determine 11-hydroxy-eicosatetraenoic acid, HXB3, HXB4, HXD3, TrXB3 and TrXD3 as potential peroxisome proliferator-activated receptor-γ partial agonists. These findings may facilitate physiological studies and drug development based on lipid mediators.
Here, we identify ten types of HXs and TrXs, produced by the prokaryote Myxococcus xanthus, of which six types are new, namely, HXB5, HXD3, HXE3, TrXB5, TrXD3 and TrXE3.
We succeed in the biotransformation of PUFAs into eight types of HXs (>35% conversion) and TrXs (>10% conversion) by expressing M. xanthus 12-LOX or 11-LOX with or without EH in Escherichia coli. We determine 11-hydroxy-eicosatetraenoic acid, HXB3, HXB4, HXD3, TrXB3 and TrXD3 as potential peroxisome proliferator-activated receptor-γ partial agonists. These findings may facilitate physiological studies and drug development based on lipid mediators.
2.
https://www.ncbi.nlm.nih.gov/pubmed/26666460
3.
https://www.ncbi.nlm.nih.gov/pubmed/26677076
4.
https://www.ncbi.nlm.nih.gov/pubmed/20016244
5. Angioneogenesis?? Tästä löytyi : psoriasis.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5895645/figure/F2/
6. hepoxilin, psoriasis
https://www.ncbi.nlm.nih.gov/pubmed/?term=hepoxilin%2C+psoriasis
Etiketter:
Hepoxiliini ja trioksiliinitutkimuksia 2018
måndag 4 juni 2018
(2) Hepoxiliinit Hx ja trioxiliinit TrX
Historiasta.
Hepoxiliinit HsA3 ja HxB3 tunnistettiin jo vuonna 1984. Niiden
havaittiin stimuloivan insuliinineritystä haimasaarekkeissa
koe-eläimellä. Tämän havaitsi Pace-Asciak CR et Martin JM.
Pace-Asciak myös tunnsiti, nimesi ja osoitti niiden
insuliinisekretagogisen aktiivisuuden.
-
History HxA3 and HxB3 were first identified, named, shown to have biological activity in stimulating insulin secretion in cultured rat pancreatic islets of Langerhans in Canada in 1984 by CR Pace-Asciak and JM Martin.[1] Shortly thereafter, Pace-Asciak identified, named, and showed to have insulin secretagogue activity HxA4 and HxB4.[2]
Nomenclature
Hepoxiliinit
ARAKIDONIHAPPO (AA) JOHDANNAISET
Hepoxiliinit Hx (HXA3 ja HxB3 ovat muista eikosanoideista eroavia
sikäli, että ne ovat muodosotuneet 20 hiilen rasvahapoista
oksidoitumalla siten, että niissä on sekä epoksidi että
hydroksiditähteitä. Rakenteellisesti ne eroavat erityisesti
kahdesta muusta arakidonin eikosanoidiryhmästä LT ja LX
(leukotrieenit ja lipoksiinit) siinä, että niistä puuttuu
konjugoituneet kaksoissidokset.
Arakidonihapon ei-klassisista
eikosanoideista tulee hepoxiliinejä 14,15-HxA3 ja 14,15-HxB3
(ultimate double bond, last double bond, viimeiseen kaksoissidokseen
muodostunut epoksiryhmä). Niitä muodostuu toista metabolista tietä
kuin mainitut klassisset eikosanoidit ja niiden hepoksiliinit.
-
HxA3, HxB3, and their isomers are distinguished from most other eicosanoids (i.e. signaling molecules made by oxidation of 20-carbon fatty acids) in that they contain both epoxide and hydroxyl residues; they are structurally differentiated in particular from two other classes of arachidonic acid-derived eicosanoids, the leukotrienes and lipoxins, in that they lack conjugated double bonds.
-
The 14,15-HxA3 and 14,15-HxB3 non-classical eicosanoids are distinguished from the aforementioned hepoxilins in that they are formed by a different metabolic pathway and differ in the positioning of their epoxide and hydroxyl residues.
EIKOSAPENTAEENIHAPPO (EPA)
JOHDANNAISET
Hepoxiliinit HxA4 ja HxB4 eroavat vastaavista arakidonihapon
hepoksiliineistä siinä, että niissä on neljä kaksoissidosta (eikä kolme) jäljellä.
-
HxA4 and HxB4 are
distinguished from HxA3 and HxB3 by possessing four rather than
three double
bonds.
Hepoxiliinin kaltaiset
DOKOSAHEXAEENIHAPON (DHA, C22:6 n3)
hepoxiliinijohdannaiset
LINOLIHAPON(LA, C18:2 n6) hepoxiliinin
kaltainen johdannainen sfingosiini, esteröitynyt
omega-hydroksyloitunut-sfingosiini (EOS)
-
Two other classes of
epoxyalcohol fatty acids, those derived from the 22-carbon
polyunsaturated fatty acid, docosahexaenoic acid, and the 18-carbon
fatty acid, linoleic acid, are distinguished from the aforementioned
hepoxilins by their carbon chain length; they are termed
hepoxilin-like rather than hepoxilins.[3][4]
A hepoxilin-like derivative of linoleic acid is formed on linoleic
acid that is esterified to a sphingosine
in a complex lipid termed esterified omega-hydroxylacyl-sphingosin
(EOS).[4]
Note on nomenclature ambiguities
Kahdesta tärkeästä näkökohdasta hepoxiliinien ja niiden
kaltaisten yhdisteiden rakenteelliset identiteetit useimmissa
tutkimuksissa ovat epäselviä. Ensinnäkin niiden OH-ryhmien
R/S-kiraalisuus alkututkimuksissa ja useassa myöhemmässä
tutkimuksessa on määrittämätön ja sen takia ilmaistaan esm.
HxB3n suhteen 10R/S-OH eli 10R/S hydroxy tai vain 10-OH eli
10-hydroxy.
Toiseksi epoksidin R,S tai S,R kiraalisuus on
määrittämättä ja ilmaistaan esim. HxB3:n suhteen
11,12-epoksidina. Muutamissa myöhemmissä tutkimuksissa on
määritelty näiden tähteiden kiraalisuus, mutta ei ole varmaa,
jos löytö on verrannollinen entisiin.
-
The full structural identities of the hepoxilins and hepoxilin-like compounds in most studies are unclear in two important respects. First, the R versus S chirality of their hydroxy residue in the initial and most studies thereafter is undefined and therefore given with, for example, HxB3 as 10R/S-hydroxy or just 10-hydroxy. Second, the R,S versus S,R chirality of the epoxide residue in these earlier studies likewise goes undefined and given with, for example, HxB3 as 11,12-epoxide. While some later studies have defined the chirality of these residues for the products they isolated,[5] it is often not clear that the earlier studies dealt with products that had exactly the same or a different chirality at these residues.
Biokemiaa, Biochemistry
Tuotanto
ARAKIDONIHAPPOPERÄISET HEPOXILIINIT
(Hx3)
Ihmisen arakidonihappoperäiset hepoxiliinit (HxA3, HxB3)
muodostuvat kahden vaiheen reaktioissa.
(1) Molekulaarinen happi O2
vaikuttaa yhteen kaksoissidokseen (Z12) ja toisessa kohtaa siirtyy
kaksoissidos ja muodostuu hydroperoksidijohdos 12S-HpETE.
2) 12S-HpETE konvertoituu hepoxiliiniksi HxA3 (Kuva Wikipediassa)
IUPAC nimi on
aika hankala, rakenne ilmaistaan pätkä kerrallaaa sen nimityksen tarkkuuden esiinsaamiseksi.
Toinen reaktio, jossa HpETE muoto muuttuu hepoxiliieniksi HxA3 tai
HxB3 , saattaa riippuva entsyymistä ALOX12.
Poistogeenisiin tutkimuksiin perustuen ALOXE3, epidermaalinen
lipoxygenaasi, vastaisi ainakin hiiren ihossa ja spinaalisessa
kudoksessa 12(S)-HPETE muodon konversioista HxB3- muotoon.
Kudoksen 12(S)-HPETE muuttunee ei - entsymaattisestikin muotoihin HxA3 ja HxB3. Ei-entsymaattinen hepoxiliinimuodostus saattaa olla artefaktaa.
Kudoksen 12(S)-HPETE muuttunee ei - entsymaattisestikin muotoihin HxA3 ja HxB3. Ei-entsymaattinen hepoxiliinimuodostus saattaa olla artefaktaa.
Lopuksi solun peroksidaasit vähentävät helposti ja nopeasti
12(S)-HPETE-muotoa sen hydroksi-analogiksi 12(S)-HETE,
12-hydroksieikosatetraeenihappo. Tämä reaktio kilpailee
hepoxiliinien muodostumisen kanssa soluissa, joissa
peroksidaasiaktiivisuus on hyvin suuri ja vastannee
hepoxiliinituotannon blokeeraamisesta.
Entsyymi LOX15 vastaa arakidonihapon metaboloimisesta
14,15-hepoxiliiniA3:ksi . Tässä tiessä , jossa ultimate (last
double bond) on muuntunut, on seuraavia tapahtumia. Ensin muodostuu
15-asemaan hydroperoksidi ja tulee 15(S)-HpETE ja siitä kaksi hepoksiliini-isomeeriä
14,15-HxA ja 14,15-HxB.
ALOX15 pystyy tekemään kummatkin reaktiovaiheet, vaikka jatkotutkimukset voivatkin osoittaa, että ALOXE3 ja ei-entsymaattiset uudelleenjärjestäytymiset sekä 15(S)-HPETE:n redusoituminen vastaavan 15(S) HETE- muotoon saattavat olla osallisia tuotteissa 14,15-HxA3 ja 14,15-HxB3 ( ultimate asema).
ALOX15 pystyy tekemään kummatkin reaktiovaiheet, vaikka jatkotutkimukset voivatkin osoittaa, että ALOXE3 ja ei-entsymaattiset uudelleenjärjestäytymiset sekä 15(S)-HPETE:n redusoituminen vastaavan 15(S) HETE- muotoon saattavat olla osallisia tuotteissa 14,15-HxA3 ja 14,15-HxB3 ( ultimate asema).
-
Production
-
Human HxA3 and HxB3 are formed in a two-step reaction.
(1) First, molecular oxygen (O2) is added to carbon 12 of arachidonic acid (i.e. 5Z,8Z,11Z,14Z-eicosatetraenoic acid) and concurrently the 8Z double bond in this arachidonate moves to the 9E position to form the intermediate product, 12S-hydroperoxy-5Z,8Z,10E,14Z-eicosatetraenoic acid (i.e. 12S-hydroperoxyeicosatetraenoic acid or 12S-HpETE).
(2) Second, 12S-HpETE is converted to the hepoxilin products, HxA3 (i.e. 8R/S-hydroxy-11,12-oxido-5Z,9E,14Z-eicosatrienoic acid) and HxB3 (i.e. 10R/S-hydroxy-11,12-oxido-5Z,8Z,14Z-eicosatrienoic acid).[3]
This two-step metabolic reaction is illustrated below:
5Z,8Z,11Z,14Z-eicosatetraenoic acid + O2
→ 12S-hydroperoxy-5Z,8Z,10E,14Z-eicosatetraenoic acid
→ 8R/S-hydroxy-11,12-oxido-5Z,9E,14Z-eicosatrienoic acid
+ 10R/S-hydroxy-11,12-oxido-5Z,8Z,14Z-eicosatrienoic acid.
The second step in this reaction, the conversion of 12(S)-HpETE to HxA3 and HxB3, may be catalyzed by ALOX12 as an intrinsic property of the enzyme.[6]
Based on gene knockout studies, however, the epidermal lipoxygenase, ALOXE3, or more correctly, its mouse ortholog Aloxe3, appears responsible for converting 12(S)-HpETE to HxB3 in mouse skin and spinal tissue.[4][7][8]
It is suggested that ALOXE3 contributes in part or whole to the production of HxB3 and perhaps other hepoxilins by tissues where it is expressed such as the skin.[4][9]
Furthermore, hydroperoxide-containing unsaturated fatty acids can rearrange non-enzymatically to form a variety of epoxyalcohol isomers.[10]
The 12(S)-HpETE formed in tissues, it is suggested, may similar rearrange non-enzymatically to form HxA3 and HXB3.[4]
Unlike the products made by ALOX12 and ALOXE3, which are stereospecific in forming only HxA3 and HxB3, however, this non-enzymatic production of hepoxilins may form a variety of hepoxilin isomers and occur as an artifact of tissue processing.[4]
Finally, cellular peroxidases readily and rapidly reduce 12(S)-HpETE to its hydroxyl analog, 12S-hydroxy-5Z,8Z,10E,14Z-eicosatetraenoic acid (12S-HETE; see 12-hydroxyeicosatetraenoic acid; this reaction competes with the hepoxilin-forming reaction and in cells expressing very high peroxidase activity may be responsible for blocking the formation of the hepoxilins.[3
-
ALOX15 is responsible for metabolizing arachidonic acid to 14,15-HxA3 and 14,15-HxB3 as indicated in the following two-step reaction which first forms 15(S)-hydroperoxy-5Z,8Z,11Z,13E-eicosatetraenoic acid (15S-HpETE) and then two specific isomers of
11S/R-hydroxy-14S,15S-epoxy-5Z,8Z,12E-eicosatrienoic acid (i.e. 14,15-HxA3) and
13S/R)-hydroxy-14S,15S-epoxy-5Z,8Z,11Z-eicosatrienoic acid (i.e. 14,15-HxB3):
5Z,8Z,11Z,14Z-eicosatetraenoic acid + O2
→ 15(S)-hydroperoxy-5Z,8Z,11Z,13E-eicosatetraenoic acid
→ 11R-hydroxy-14S,15 S-epoxy-5Z,8Z,12E-eicosatrienoic acid
and 13R-hydroxy-14S,15S-epoxy-5Z,8Z,11Z-eicosatrienoic acid
-
ALOX15 appears capable of conducting both steps in this reaction[11] although further studies may show that ALOXE3, non-enzymatic rearrangements, and the reduction of 15S-HpETE to 15(S)-hydroxy-5Z,8Z,11Z,13E-eicosatetraenoic acid (i.e. 15S-HETE; see 15-hydroxyicosatetraenoic acid) may be involved in the production of 14,15-HxA3 and 14,15-HxB3 as they are in that of HxA3 and HxB3.
DOKOSAHEXAEENIHAPPO (DHA, C22:6 n3), Hepoxiliinin kaltaiset metaboliittit
Hepoxiliinin kaltaisia metaboliitteja DHA:sta pääteltiin niiden
trioksiliinimetaboliitteista (Trx) eli trihydroksimetaboliiteista
käsin - näitä oli tuloksena, kun dokosahexaeenihappoa lisättiin
rotasta saatuihin käpylisäke- tai hippokampi-isolaateihin. (DHA on
aivoissa hyvin tavallinen rasvahappomuoto):
7-OH-bis-alfa-dihomo-HxA5
10-OH-bis-alfa-dihomo-HxA5
-
Production of the hepoxilin-like metabolites of docosahexaenoic acid,
7R/S-hydroxy-10,11-epoxy-4Z,7E,13Z,16Z,19Z-docosapentaenoic acid
(i.e. 7-hydroxy-bis-α-dihomo-HxA5) and
10-hydroxy-13,14-epoxy-4Z,7EZ,11E,16Z,19Z-docosapentaenoic acid
(i.e. 10-hydroxy-bis-α-dihomo-HxA5)
was formed (or inferred to be formed based on the formation of their trihydroxy metabolites (see trioxilins, below) as a result of adding docosahexaenoic acid to the pineal gland or hippocampus isolated from rats; the pathway(s) making these products has not been described.[3][12]
LINOLIHAPPO (LA, C18:2 n6), hepoxiliinien kaltaiset metaboliitit
Sekä ihmisellä että jyrsijöillä muodostuu ihossa/nahkassa
hepoxiliinien kaltaisia metaboliitteja. Tämä hepoxiliini on
esteröitynyttä sfinganiinia lipidikompleksissa (EOS,
esteröitynyttä omega-OH-asyylisfingosiinia). Nämä asyylit eli
rasvahappotähteet, joita sfinganiini ottaa esterisidoksilla vastaan
voivat olla hyvin pitkiä rasvahappoja ( VLCFA, kuten aivojen
sfingomyeliinissä).
Tässä metabolisessa tiessä ALOX12B metaboloi esteröityneen
linolihapon 9R-hydroperoksijohdannaiseksi ja sitten ALOXE3 metaboloi
tämän aineenvaihdunnallisen välituotteen
13-hydroxy-9,10-epoxituotteeksi. Tästä aineenvaihdunnallisesta
tiestä ihoon saadaan asettumaan hyvin pitkäketjuisia rasvahappoja ihon
pinnan sarveistuneeseen lipidivaippaan.
-
A hepoxilin-like metabolite of linoleic acid forms in the skin of humans and rodents. This hepoxilin is esterified to sphinganine in a lipid complex termed EOS (i.e. esterified omega-hydroxyacyl-sphingosine, see Lipoxygenase#Biological function and classification#Human lipoxygenases) that also contains a very long chain fatty acid. In this pathway, ALOX12B metabolizes the esterified linoleic acid to its 9R-hydroperoxy derivative and then ALOXE3 metabolizes this intermediate to its 13R-hydroxy-9R,10R-epoxy product. The pathway functions to deliver very long chain fatty acids to the cornified lipid envelope of the skin surface.[9]Kommenttini: Harper 1969: Tiedettiin jo 1958 linolihapon merkitys ihovaurioita parantavana ja essentiellinä rasvahappona. Samoin tiedettiin että linolihapon konversiossa arakidonihapoksi tarvittiin B6 vitamiinia , kuten palmitiinihapon konversiossa sfingosiiniksi.
-
Harper jo 1969 mainitsee joitain aivojen tyypillisiä VLCFA rasvahappoja C24 lignoseriinihappo C24:0), nervonihappo 8C24:1), cerebronihappo (2-OH-C24:0), joita liittyy sfingosiiniin kerebrosideissa (sfingomyeliinin osissa). Laajentunut käsitys esentiellien rsvahappojen metaboliiteista on viime vuosikymmenien tietoa. Katabolinen tiekin on asia sinänsä.
Aineenvaihdunnan jatkoa
Hepoxiliini A3 on äärimmäisen epästabiili ja hepoxiliini B3 on
kohtalaisen epästabiili ja ne muuttuvat nopeasti vastaaviksi
trihydroksituotteikseen (TrX), kuten esim. kemiallisten isolaatioprosessien
aikana jo lievästäkin happamuudesta metodissa. Ne metaboloituvat
nopeaati myös soluissa näiksi samoiksi trihydroksy-tuotteikseen,
joita nimitetään trioksiliineiksi(Trx) tai
trihydroksieikosatrieenihapoiksi (THETA).
Hepoksiliini A3 muuttuu trioksiliini A3:ksi (TrXA3).
Hepoksiliini B muuttuu trioksiliini B3:ksi (TrXB3).
Kolmas trioksiliinihappo arakidonihappolinjasta on trioksiliini C
(TrXC), jota on havaittu koe-eläimen aorttakudoksesta
arakidonihappoinkubaatiossa.
sEH-entsyymi, liukoinen
epoksidihydrolaasi, vaikuttaa HxA3:n muuttumisen TrXA3:ksi ja HxB3:n
muuttumisen TrX muotoon hiiren maksassa. Tätä entsyymiä on
laajalti kudoksissa myös ihmisellä ja se voi olla pääasiallinen
metaboloiva entsyymi näille ja muillekin hepoxiliinituotteille.
Hepoxiliinihydrolaasiaktiivisuutra voi olla muillakin entsyymeillä kuten mikrosomaalisella epoxidihydrolaasilla tai epoxidihydrolaasi 2:lla.
Hepoxiliinituotannon trihydroksituotteet katsotaan inaktiiveiksi ja SEH-tie pidetään sen takia hepoxiliineja rajoittavana tienä, mutta kuitenkin on havaittu, että TrXA3, TRXB3 ja TRXC3 olivat koe-eläimessä hepoxiliinia HxA3 vahvempia supistetun arterian relaksoijia. Samoin TrXC3 relaksoi suhteellisen vahvasti supistunutta aorttaa.
Hepoxiliinihydrolaasiaktiivisuutra voi olla muillakin entsyymeillä kuten mikrosomaalisella epoxidihydrolaasilla tai epoxidihydrolaasi 2:lla.
Hepoxiliinituotannon trihydroksituotteet katsotaan inaktiiveiksi ja SEH-tie pidetään sen takia hepoxiliineja rajoittavana tienä, mutta kuitenkin on havaittu, että TrXA3, TRXB3 ja TRXC3 olivat koe-eläimessä hepoxiliinia HxA3 vahvempia supistetun arterian relaksoijia. Samoin TrXC3 relaksoi suhteellisen vahvasti supistunutta aorttaa.
HxA3 pystyttiin muuttamaan glutationikonjugaatikseen HxA3-C,
11-glutationyyli-HxA3, soluttomassa systeemissä tai
hippokampihomogenaatissa. Tämä HxA3-C osoittautui olevan vahva
kalvon hyperpolarisaation stimuloija hippokampin CA1-neuroneissa.
Tämä on LTC4 analogi ;( LTC4 on leukotrieeni LTA4, johon on konjugoitunut
glutationi).
On havaittu 14,15-HxA3 ja 14,15-HxB3
glutationikonjugaatteja Hodginin taudin Reed- Sternberg-solulinjassa.
HxB3 ja TrX3 ovat olleet esteröityneinä sn2-asemaan ihmisen psoriasisleesion fosfolipidissä ja psoriaattiset ihonäytteet asyloivat HxB.. ja TrX.. näihin fosfolipideihin koeputkessa. ( Tässä ei ole selitystä, mitä nämä HxBw ja TrX2 tarkoittavat tai ovatko w ja 2 painovirhe).
HxB3 ja TrX3 ovat olleet esteröityneinä sn2-asemaan ihmisen psoriasisleesion fosfolipidissä ja psoriaattiset ihonäytteet asyloivat HxB.. ja TrX.. näihin fosfolipideihin koeputkessa. ( Tässä ei ole selitystä, mitä nämä HxBw ja TrX2 tarkoittavat tai ovatko w ja 2 painovirhe).
-
HxA3 is extremely unstable and HxB3 is moderately unstable, rapidly decomposing to their tri-hydroxy products, for example, during isolation procedures that use an even mildly acidic methods; they are also rapidly metabolized enzymatically in cells to these same tri-hydroxy products, termed trioxilins (TrX's) or trihydroxyeicoxatrienoic acids (THETA's); HxA3 is converted to 8,11,12-trihydroxy-5Z,9E,14Z-eicosatrienoic acid (trioxilin A3 or TrXA3) while TxB3 is converted to 10,11,12-trihydroxy-5Z,8Z,14Z-eicosatrienoic acid (trioxilin B3 or TrXB3).[3][13] A third trihydroxy acid, 8,9,12-trihydroxy-5Z,10E,14Z eicosatrienoic acid (trioxilin C3 or TrXC3), has been detected in rabbit and mouse aorta tissue incubated with arachidonic acid.[5][14] The metabolism of HxA3 to TrXA3 and HXB3 to TrX is accomplished by soluble epoxide hydrolase in mouse liver; since it is widely distributed in various tissues of various mammalian species, including humans, soluble epoxide hydrolase may be the principal enzyme responsible for metabolizing these and perhaps other hepoxilin compounds.[3][15] It seems possible, however, that other similarly acting epoxide hydrolases such as microsomal epoxide hydrolase or epoxide hydrolase 2 may prove to hepoxilin hydrolase activity. While the trihydroxy products of hepoxilin synthesis are generally considered to be inactive and the sEH pathway therefore considered as functioning to limiting the actions of the hepoxilins,[3][16] some studies found that TrXA3, TrXB3, and TrXC3 were more powerful than HxA3 in relaxing pre-contracted mouse arteries[5] and that TrXC3 was a relatively potent relaxer of rabbit pre-contracted aorta.[14]
-
HxA3 was converted through a Michael addition catalyzed by glutathione transferase to its glutathione conjugate, HxA3-C, i.e., 11-glutathionyl-HxA3, in a cell-free system or in homogenates of rat brain hippocampus tissue; HxA3-C proved to be a potent stimulator of membrane hyperpolarization in rat hippocampal CA1 neurons.[17] This formation of hepoxilin A3-C appears analogous to the formation of leukotriene C4 by the conjugation of glutathione to leukotriene A4. Glutathione conjugates of 14,15-HxA3 and 14,15-HxB3 have also been detected the human Hodgkin disease Reed–Sternberg cell line, L1236.[11]
-
HxB3 and TrX3 are found esterified into the sn-2 position of phospholipid in human psoriasis lesions and samples of human psoriatic skin acylate HxBw and TrX2 into these phospholipids in vitro.[3][18]
Fysiologiset vaikutukset
Miltei kaikki biologiset tutkimukset hepoxiliineistä on tehty
eläimissä tai koeputkessa eläin- tai ihmiskudoksista. Kuitenkin
näsitä tutkimuksista saa lajispesifisiä erovia tuloksia, mikä
komplisoi asian relevanssin ihmiselle. Näiden tutkimusten hyöty
ihmisfysiologiaan, patologiaan ja kliiniseen lääketieteeseen ja
terapiatasoon vaatii paljon lisätutkimusta.
- Virtually all of the biological studies on hepoxilins have been conducted in animals or in vitro on animal and human tissues, However, these studies give species-specific different results which complicate their relevancy to humans. The useful translation of these studies to human physiology, pathology, and clinical medicine and therapies requires much further study.
Tulehdus
HxA3 ja HxB3 omaavat
proinflammatorisia vaikutuksia, esimerkiksi ne stimuloivat
neutrofiilien kemotaxista ja lisäävät ihokapillaarien
permeabiliteettia. Ihmisillä tehdyt tutkimukset ovat osoittaneet,
että HxB3-pitoisuus on yli 16 kertaa korkeampi psoriaattisissa
ihovaurioissa kuin normaalissa epidermiksessä – psoriasishilseessä
sitä oli noin 10 mikromoolin pitoisuuksissa, millä on biologista
vaikutusta. Varsinaista HxB3- muotoa ei näissä kudoksissa
esiintynyt, vaan se pääteltiin metaboliitistaan TxB3, jota oli
suhteellisen korkeat pitoisuudet psoriasishilseessä, mutta ei
normaalissa epidermiksessä. Nämä tulokset viittaavat siihen, että
HxA3 ja HxB3 hepoxiliinien proinflammatoriset vaikutukset voivat
antaa osansa psoriasista seuraavaan tulehdusvasteeseen ja ehkä
muihinkin tulehduksellisiin ihotiloihin.
HxA3 on osallistunut jyrsijäsuolistossa ja keuhkossa eri bakteerien aiheuttamaan neutrofiilipohjaiseen tulehdusvasteeseen. Tästä mahdollistuu tämän hepoxiliinin edistävä vaikutus muidenkin kudosten tulehdusvasteisiin, erityisesti limakalvopintaisissa kudoksissa ihon lisäksi.
Lisäksi HxA3 ja HxB3:n synteettinen analogi PBT-3 indusoivat ihmisen neutrofiilejä tuottamaan neutrofiilin extrasellulaarista verkostoa, nimittäin DNA-pitoista solunulkoista säiematriisia, histonipitoista kromatiinia, joka kykenee tappamaan solun ulkopuolisia patogeenejä minimoimalla kudosta; näin nämä hepoxiliinit voivat ottaa osaa luonnolliseen immuniteettiin vastaamalla patogeenien suorasta tuhoamisesta.
HxA3 on osallistunut jyrsijäsuolistossa ja keuhkossa eri bakteerien aiheuttamaan neutrofiilipohjaiseen tulehdusvasteeseen. Tästä mahdollistuu tämän hepoxiliinin edistävä vaikutus muidenkin kudosten tulehdusvasteisiin, erityisesti limakalvopintaisissa kudoksissa ihon lisäksi.
Lisäksi HxA3 ja HxB3:n synteettinen analogi PBT-3 indusoivat ihmisen neutrofiilejä tuottamaan neutrofiilin extrasellulaarista verkostoa, nimittäin DNA-pitoista solunulkoista säiematriisia, histonipitoista kromatiinia, joka kykenee tappamaan solun ulkopuolisia patogeenejä minimoimalla kudosta; näin nämä hepoxiliinit voivat ottaa osaa luonnolliseen immuniteettiin vastaamalla patogeenien suorasta tuhoamisesta.
- Inflammation
-
HxA3 and HxB3 possess pro-inflammatory actions in, for example, stimulating human neutrophil chemotaxis and increasing the permeability of skin capillaries.[3][19] Studies in humans have found that the amount of HxB3 is >16-fold higher in psoriatic lesions than normal epidermis. It is present in psoriatic scales at ~10 micromolar, a concentration which is able to exert biologic effects; HxB3 was not detected in these tissues although its present was strongly indicated by the presence of its metabolite, TrXB3, at relatively high levels in psoriatic scales but not normal epidermal tissue.[13] These results suggest that the pro-inflammatory effects of HxA3 and HxB3 may contribute to the inflammatory response that accompanies psoriasis and perhaps other inflammatory skin conditions.[3][13][20][21] HxA3 has also been implicating in promoting the neutrophil-based inflammatory response to various bacteria in the intestines and lungs of rodents.;[22][23] this allows that this hepoxilin may also promote the inflammatory response of humans in other tissues, particularly those with a mucosa surface, besides the skin. In addition, HxA3 and a synthetic analog of HxB3, PBT-3, induce human neutrophils to produce neutrophil extracellular traps, i.e. DNA-rich extracellular fibril matrixes able to kill extracellular pathogens while minimizing tissue; hence these hepoxilins may contribute to innate immunity by being responsible of the direct killing of pathogens.[24]
Verenkierto
Sekä 12S-HETE ja
12R-HETE että HxA3 ja TrXA3 vaikuttavat hiiren tromboksaani A2:lla
(TXA2) supistetuissa mesenteriaalivaltimoissa relaksaatiota, mutta
tätä vaikutusta ei saatu esiin HxB3 eikä TrX3:lla.
Mekanistisesti näitä metaboliitteja muodostuu suoniendoteelissä, niitä liikkuu alla olevaan sileään lihakseen ja ne purkavat reseptoriantagonisteina sileän lihaksen supistustilan, jonka TXA2 on saanut aikaan vaikuttamalla reseptoriinsa (tromboxaanireseptori alfaisomeeri).
Mekanistisesti näitä metaboliitteja muodostuu suoniendoteelissä, niitä liikkuu alla olevaan sileään lihakseen ja ne purkavat reseptoriantagonisteina sileän lihaksen supistustilan, jonka TXA2 on saanut aikaan vaikuttamalla reseptoriinsa (tromboxaanireseptori alfaisomeeri).
Arakidonihapon
15-LOX johdannaiset epoksialkoholi- ja TrX-metaboliitit kuten
15-hydroxy-11,12-epoxyeikosatrieenihappo,
13-hydroksy-14,15-epoxy-eikosatrieenihappo
( 14,15 HxA4 isomeeri EPA- rasvahaposta?)
11,12,14-
trihydroksieikosatrieenihappo arakidonihaposta
laajentavat kaniinin
aorttaa EDHF-mekanismilla eli endoteeliperäisellä
hyperpolarisoivalla tekijällä. Ne muodostuvat suonen endoteelissä,
liikkuvat allaolevaan sileään lihakseen ja liipaisevat esiin
hyperpolarisaation indusoiman relaksaation sitoutumalla kalsiumilla
aktivoituvaan kaliumkanavan (SK-kanavan). Mainitut metaboliitit
voivat käyttää yhtä tai molempia näistä kahdesta mekanismista
erilaisissa vaskulaarikerroksissa ja eri eläinlajeissa antaen
oman osansa paikallisverenkierron ja systeemisen verenpaineen
säätelyyn.Näitä mainittuja metaboliitteja ei ole tutkittu
ihmiskudoksissa. Kuitenkin 12S-HETE, 12R-HETE , HxA3, TrXA3 ja TrXC3
vaikuttavat estämällä TXA:n sitoutumista ihmisen
tromboksaanireseptoriin.
-
Circulation.
-
In addition to 12S-HETE and 12R-HETE (see 12-HETE#Blood pressure), HxA3, TrXA3, and TrXC3 but neither HxB3 nor TrXB3 relax mouse mesentery arteries pre-contracted by thromboxane A2)(TXA2). Mechanistically, these metabolites form in the vascular endothelium, move to the underlining smooth muscle, and reverse the smooth muscle contraction caused by TXA2 by functioning as a Receptor antagonist, i.e. they competitively inhibit the binding of TXA2 to its thromboxane receptor, α isoform.[5]
-
Contrastingly, 15-lipoxgenase-derived epoxyalcohol and trihydroxy metabolites of arachidonic acid viz., 15-hydroxy-11,12-epoxyeicosatrienoic acid, 13-hydroxy-14,15-epoxy-eicosatrienoic acid (a 14,15-HxA4 isomer), and 11,12,15-trihydroxyeicosatrienoic acid dilate rabbit aorta by an Endothelium-derived hyperpolarizing factor (EDHF) mechanism, i.e. they form in the vessels endothelium, move to underlying smooth muscles, and trigger a response of Hyperpolarization (biology)-induced relaxation by binding to and thereby opening their apamin-sensitive small conductance (SK) Calcium-activated potassium channel#SK channels.[5][25][26] The cited metabolites may use one or the other of these two mechanisms in different vascular beds and in different animal species to contribute in regulating regional blood flow and blood pressure. While the role of these metabolites in the human vasculature has not been studied, 12S-HETE, 12R-HETE, HxA3, TrXA3, and TrXC3 do inhibit the binding of TXA2 to the human thromboxane receptor.[5][27]
Kipuaistimus
HxA3 ja HxB3
näyttävät olevan osallisena hyperalgesia- ja taktiili
allodynia-vasteisiin (kosketusarkuus normaalisti kivuttomalle
stimulukselle) - kipuvaste tutkittuna hiireltä ihotulehduksessa.
Tässä mallissa hepoxiliinejä vapautui selkäytimestä ja ne
aktivoivat suoraan TRPV1 ja TRPA1 reseptoreita vahvistaen
kiputuntemusta.
TRPV1 on
kationikanavan erästä alaryhmää, kapsaisiinireseptori,
vanilloidireseptori. TRPA1 on myös tällainen hetkelliseen
jonimuutokseen vastaava kationikanava-alatyyppi. Ne ovat solun
plasmakalvon jonikanavia. Näitä on sekä eläimillä että
ihmisillä ja niiden tiedetään osallistuvan exogeenisten ja
endogeenisten fysikaalisten ja kemiallisten stimulusten aiheuttaman
kivun havaitsemiseen.
-
Pain perception. HXA3 and HXB3 appear responsible for hyperalgesia and tactile allodynia (pain caused by a normally non-painful stimulus) response of mice to skin inflammation. In this model, the hepoxilins are released in spinal cord and directly activate TRPV1 and TRPA1 receptors to augment the perception of pain.[3][28][29] TRPV1 (the transient receptor potential cation channel subfamily V member 1 (TrpV1), also termed the capsaicin receptor or vanilloid receptor) and TRPA1 (Transient receptor potential cation channel, member A1) are plasma membrane ion channels on cells; these channels are known to be involved in the perception of pain caused by exogenous and endogenous physical and chemical stimuli in a wide range of animal species including humans.
Oksidatiivinen stressi
Viljellyt
haimasaarekesolut oksidatiivisessa stressissä erittävät HxB3. HxB3
(ja HxA3) puolestaan säätävät ylös peroksidaasientsyymeitä,
jotka ovat stressiä vähentäviä. Oletetaan, että HxB3:n
esiinliipaisema oksidaasien indusoituminen on yleinen
kompensatorinen puolustusvaste, jota useat solut käyttävät
suojellakseen elinvoimaisuuttaan ja toiminnallisuuttaan.
-
Oxidative stress
-
Cultured rat RINm5F pancreatic islet cells undergoing oxidative stress secrete HxB3; HxB3 (and HxA3) in turn upregulates peroxidase enzymes which act to decrease this stress; it is proposed that this HxB3-triggered induction of oxidases constitutes a general compensatory defense response used by a variety of cells to protect their vitality and functionality.[30][31]
Insuliinin eritys
HxA3 ja HxB3
vaikuttavat insuliinin eritystoimintaa isoloiduissa rotan
haimasaarekesoluissa ja tässä on kyse niiden kyvystä lisätä tai
vahvistaa glukoosin insuliinin eritystä stimuloivaa vaikutusta.
Mutta tähän vaaditaan hyvin suuret hepoxiliinipitoisuudet kuten 2
mikromoolia. Eikä tätä tutkimusta ole laajennettu intakteihin
eläimiin tai ihmisiin.
Hepoxiliinejä tuottuu myös
aivoissa.
-
Insulin secretion
-
The insulin-secreting actions of HxA3 and HxB3 on isolate rat pancreatic islet cells involves their ability to increase or potentiate the insulin-secreting activity of glucose, requires very high concentrations (e.g. 2 micromolar) of the hepoxilins, and has not been extended to intact animals or humans.[3][32]
Viitteet, References
-
Pace-Asciak CR, Martin JM (1984). "Hepoxilin, a new family of insulin secretagogues formed by intact rat pancreatic islets". Prostaglandins, Leukotrienes, and Medicine. 16 (2): 173–80. doi:10.1016/0262-1746(84)90069-6. PMID 6396652.
-
Pace-Asciak, C. R. (1986). "Formation of hepoxilin A4, B4 and the corresponding trioxilins from 12(S)-hydroperoxy-5,8,10,14,17-icosapentaenoic acid". Prostaglandins, Leukotrienes, and Medicine. 22 (1): 1–9. doi:10.1016/0262-1746(86)90017-x. PMID 3012585.
-
Pace-Asciak, C. R. (2015). "Pathophysiology of the hepoxilins". Biochimica et Biophysica Acta. 1851 (4): 383–96. doi:10.1016/j.bbalip.2014.09.007. PMID 25240838.
-
Muñoz-Garcia, A; Thomas, C. P.; Keeney, D. S.; Zheng, Y; Brash, A. R. (2014). "The importance of the lipoxygenase-hepoxilin pathway in the mammalian epidermal barrier". Biochimica et Biophysica Acta. 1841 (3): 401–8. doi:10.1016/j.bbalip.2013.08.020. PMC 4116325 . PMID 24021977.
-
Siangjong, L; Goldman, D. H.; Kriska, T; Gauthier, K. M.; Smyth, E. M.; Puli, N; Kumar, G; Falck, J. R.; Campbell, W. B. (2015). "Vascular hepoxilin and trioxilins mediate vasorelaxation through TP receptor inhibition in mouse arteries". Acta Physiologica: n/a. doi:10.1111/apha.12642. PMID 26666460.
-
Dobrian, A. D.; Lieb, D. C.; Cole, B. K.; Taylor-Fishwick, D. A.; Chakrabarti, S. K.; Nadler, J. L. (2011). "Functional and pathological roles of the 12- and 15-lipoxygenases". Progress in Lipid Research. 50 (1): 115–31. doi:10.1016/j.plipres.2010.10.005. PMC 3012140 . PMID 20970452.
-
Gregus, A. M.; Dumlao, D. S.; Wei, S. C.; Norris, P. C.; Catella, L. C.; Meyerstein, F. G.; Buczynski, M. W.; Steinauer, J. J.; Fitzsimmons, B. L.; Yaksh, T. L.; Dennis, E. A. (2013). "Systematic analysis of rat 12/15-lipoxygenase enzymes reveals critical role for spinal eLOX3 hepoxilin synthase activity in inflammatory hyperalgesia". The FASEB Journal. 27 (5): 1939–49. doi:10.1096/fj.12-217414. PMC 3633813 . PMID 23382512.
-
Krieg, Peter; Rosenberger, Sabine; De Juanes, Silvia; Latzko, Susanne; Hou, Jin; Dick, Angela; Kloz, Ulrich; Van Der Hoeven, Frank; Hausser, Ingrid; Esposito, Irene; Rauh, Manfred; Schneider, Holm (2013). "Aloxe3 Knockout Mice Reveal a Function of Epidermal Lipoxygenase-3 as Hepoxilin Synthase and Its Pivotal Role in Barrier Formation". Journal of Investigative Dermatology. 133 (1): 172–80. doi:10.1038/jid.2012.250. PMID 22832496.
-
Krieg, Peter; Fürstenberger, Gerhard (2014). "The role of lipoxygenases in epidermis". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1841 (3): 390–400. doi:10.1016/j.bbalip.2013.08.005. PMID 23954555. Erratum in: Biochim Biophys Acta. 2014 Dec;1841(12):1767.
-
Gardner, H. W. (1989). "Oxygen radical chemistry of polyunsaturated fatty acids". Free Radical Biology & Medicine. 7 (1): 65–86. doi:10.1016/0891-5849(89)90102-0. PMID 2666279.
-
Brunnström, Åsa; Hamberg, Mats; Griffiths, William J.; Mannervik, Bengt; Claesson, Hans-Erik (2010). "Biosynthesis of 14,15-Hepoxilins in Human L1236 Hodgkin Lymphoma Cells and Eosinophils". Lipids. 46 (1): 69–79. doi:10.1007/s11745-010-3485-1. PMID 21046276.
-
Reynaud, D; Pace-Asciak, C. R. (1997). "Docosahexaenoic acid causes accumulation of free arachidonic acid in rat pineal gland and hippocampus to form hepoxilins from both substrates". Biochimica et Biophysica Acta. 1346 (3): 305–16. doi:10.1016/s0005-2760(97)00041-6. PMID 9219915.
-
Antón, R; Puig, L; Esgleyes, T; De Moragas, J. M.; Vila, L (1998). "Occurrence of hepoxilins and trioxilins in psoriatic lesions". Journal of Investigative Dermatology. 110 (4): 303–10. doi:10.1046/j.1523-1747.1998.00159.x. PMID 9540966.
-
Pfister, S. L.; Spitzbarth, N; Nithipatikom, K; Falck, J. R.; Campbell, W. B. (2003). "Metabolism of 12-hydroperoxyeicosatetraenoic acid to vasodilatory trioxilin C3 by rabbit aorta". Biochimica et Biophysica Acta. 1622 (1): 6–13. doi:10.1016/s0304-4165(03)00097-7. PMID 12829255.
-
Cronin, A; Decker, M; Arand, M (2011). "Mammalian soluble epoxide hydrolase is identical to liver hepoxilin hydrolase". Journal of Lipid Research. 52 (4): 712–9. doi:10.1194/jlr.M009639. PMC 3284163 . PMID 21217101.
-
Muñoz-Garcia, A; Thomas, C. P.; Keeney, D. S.; Zheng, Y; Brash, A. R. (2014). "The importance of the lipoxygenase-hepoxilin pathway in the mammalian epidermal barrier". Biochimica et Biophysica Acta. 1841 (3): 401–8. doi:10.1016/j.bbalip.2013.08.020. PMC 4116325 . PMID 24021977.
-
Murphy, R. C.; Zarini, S (2002). "Glutathione adducts of oxyeicosanoids". Prostaglandins & other lipid mediators. 68-69: 471–82. doi:10.1016/s0090-6980(02)00049-7. PMID 12432937.
-
Antón, R; Camacho, M; Puig, L; Vila, L (2002). "Hepoxilin B3 and its enzymatically formed derivative trioxilin B3 are incorporated into phospholipids in psoriatic lesions". Journal of Investigative Dermatology. 118 (1): 139–46. doi:10.1046/j.0022-202x.2001.01593.x. PMID 11851887.
-
Kubala, S.A.; Patil, S.U.; Shreffler, W.G.; Hurley, B.P. (2014). "Pathogen induced chemo-attractant hepoxilin A3 drives neutrophils, but not eosinophils across epithelial barriers". Prostaglandins & Other Lipid Mediators. 108: 1–8. doi:10.1016/j.prostaglandins.2013.11.001. PMC 4004677 .
-
Christie, William W. (2006). "LEUKOTRIENES AND LIPOXINS: Chemistry and Biology". Archived from the original on March 14, 2007. Retrieved January 4, 2007.
-
Bhowmick, R.; Tin Maung, N. H.; Hurley, B. P.; Ghanem, E. B.; Gronert, K.; McCormick, B. A.; Leong, J. M. (2013). "Systemic Disease during Streptococcus pneumoniae Acute Lung Infection Requires 12-Lipoxygenase-Dependent Inflammation". The Journal of Immunology. 191 (10): 5115–23. doi:10.4049/jimmunol.1300522. PMC 3836588 . PMID 24089193.
-
Stenson, W. F. (2014). "The universe of arachidonic acid metabolites in inflammatory bowel disease: Can we tell the good from the bad?". Current Opinion in Gastroenterology. 30 (4): 347–51. doi:10.1097/MOG.0000000000000075. PMID 24837228.
-
Douda, David N.; Grasemann, Hartmut; Pace-Asciak, Cecil; Palaniyar, Nades (2015). "A Lipid Mediator Hepoxilin A3 is a Natural Inducer of Neutrophil Extracellular Traps in Human Neutrophils". Mediators of Inflammation. 2015: 1–7. doi:10.1155/2015/520871.
-
Chawengsub, Y; Gauthier, K. M.; Campbell, W. B. (2009). "Role of arachidonic acid lipoxygenase metabolites in the regulation of vascular tone". AJP: Heart and Circulatory Physiology. 297 (2): H495–507. doi:10.1152/ajpheart.00349.2009. PMC 2724209 . PMID 19525377.
-
Campbell, W. B.; Gauthier, K. M. (2013). "Inducible endothelium-derived hyperpolarizing factor: Role of the 15-lipoxygenase-EDHF pathway". Journal of Cardiovascular Pharmacology. 61 (3): 176–87. doi:10.1097/FJC.0b013e31828165db. PMC 3594564 . PMID 23249676.
-
Siangjong, L; Gauthier, K. M.; Pfister, S. L.; Smyth, E. M.; Campbell, W. B. (2013). "Endothelial 12(S)-HETE vasorelaxation is mediated by thromboxane receptor inhibition in mouse mesenteric arteries". AJP: Heart and Circulatory Physiology. 304 (3): H382–92. doi:10.1152/ajpheart.00690.2012. PMC 3774504 . PMID 23203967.
-
Gregus, A. M.; Doolen, S; Dumlao, D. S.; Buczynski, M. W.; Takasusuki, T; Fitzsimmons, B. L.; Hua, X. Y.; Taylor, B. K.; Dennis, E. A.; Yaksh, T. L. (2012). "Spinal 12-lipoxygenase-derived hepoxilin A3 contributes to inflammatory hyperalgesia via activation of TRPV1 and TRPA1 receptors". Proceedings of the National Academy of Sciences. 109 (17): 6721–6. doi:10.1073/pnas.1110460109. PMC 3340022 . PMID 22493235.
-
Gregus, A. M.; Dumlao, D. S.; Wei, S. C.; Norris, P. C.; Catella, L. C.; Meyerstein, F. G.; Buczynski, M. W.; Steinauer, J. J.; Fitzsimmons, B. L.; Yaksh, T. L.; Dennis, E. A. (2013). "Systematic analysis of rat 12/15-lipoxygenase enzymes reveals critical role for spinal eLOX3 hepoxilin synthase activity in inflammatory hyperalgesia". The FASEB Journal. 27 (5): 1939–49. doi:10.1096/fj.12-217414. PMC 3633813 . PMID 23382512.
-
M.P. Zafiriou; et al. (October–November 2007). "Prostaglandins, Leukotrienes and Essential Fatty Acids : Biological role of hepoxilins: Upregulation of phospholipid hydroperoxide glutathione peroxidase as a cellular response to oxidative stress?". Prostaglandins, Leukotrienes and Essential Fatty Acids. 77 (3–4): 209–215. doi:10.1016/j.plefa.2007.08.007. PMID 17997296. Retrieved 2007-12-04.
-
Zafiriou, Maria-Patapia; Zelarayan, Laura Cecilia; Noack, Claudia; Renger, Anke; Nigam, Santosh; Siafaka-Kapadai, Athanassia (2011). "Hepoxilin A3 protects β-cells from apoptosis in contrast to its precursor, 12-hydroperoxyeicosatetraenoic acid". Biochimica et Biophysica Acta (BBA) - Molecular and Cell Biology of Lipids. 1811 (6): 361–369. doi:10.1016/j.bbalip.2011.03.002.
-
Pace-Asciak CR (1986). "Formation of hepoxilin A4, B4 and the corresponding trioxilins from 12(S)-hydroperoxy-5,8,10,14,17-icosapentaenoic acid". Prostaglandins, Leukotrienes, and Medicine. 22 (1): 1–9. doi:10.1016/0262-1746(86)90017-X. PMID 3012585.
Etiketter:
Hepoxiliinit Hx ja trioksiliinit TrX
Prenumerera på:
Kommentarer (Atom)